Principles
利用 NAD(P)H 和 FAD FLIM 进行代谢成像
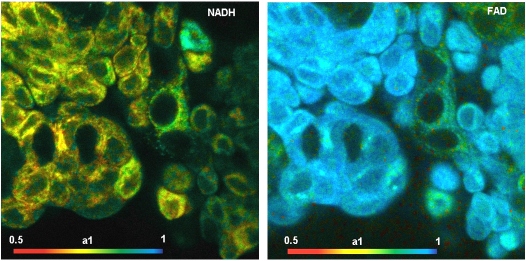
NAD(P)H(烟酰胺腺嘌呤二核苷酸)和 FAD(黄素腺嘌呤二核苷酸)是参与细胞代谢的辅酶。NAD(P)H 和 FAD 都有荧光。FAD 尤其是 NAD(P)H 的独特之处在于,它们的荧光强度和荧光衰减函数可以直接反映细胞的新陈代谢状态:NAD(P)H 和 FAD 的荧光寿命取决于与蛋白质的结合情况。未结合的 NAD(P)H 的荧光寿命约为 0.3 至 0.4 毫微秒。结合的 NAD(P)H 的荧光寿命约为 1.2 ns [9]。对于 FAD 来说,结合的效果正好相反:结合的 FAD 的寿命为几百 ps,未结合的 FAD 的寿命为几 ns。
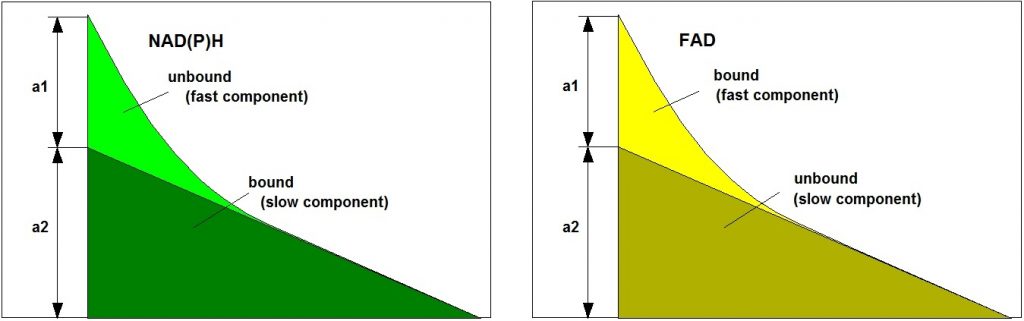
重要的是,结合和未结合的 NAD(P)H 以及结合和未结合的 FAD 的数量比例取决于新陈代谢的类型。从糖酵解到氧化磷酸化或从氧化磷酸化到糖酵解,都会导致非结合/结合比率的变化:糖酵解产生的 NAD(P)H 的 a1/a2 高,而 FAD 的 a1/a2 低;氧化磷酸化产生的 NAD(P)H 的 a1/a2 低,而 FAD 的 a1/a2 高。 结合/非结合比率直接反映了 “沃伯格效应”:在正常细胞中,氧化磷酸化占主导地位,而在癌细胞中,还原糖酵解占主导地位。因此,正常细胞和癌细胞可以通过 a1/a2 比率或仅通过 a1(因为 a1+a2= 1)来区分。需要注意的是,a1 或 a1/a2 的变化也隐含在幅度加权寿命 tm 和强度加权寿命 ti 中。然而,衰变成分本身的寿命受其他分子环境参数(如线粒体 pH 值)的影响。因此,寿命不能作为绝对的鉴别参数。
激发和发射波长
NAD(P)H 和 FAD 的近似激发和发射光谱如下图所示。从图中可以看出,只有使用不同的激发波长和不同的检测波长,才能将 NAD(P)H 和 FAD 的荧光信号区分开来。
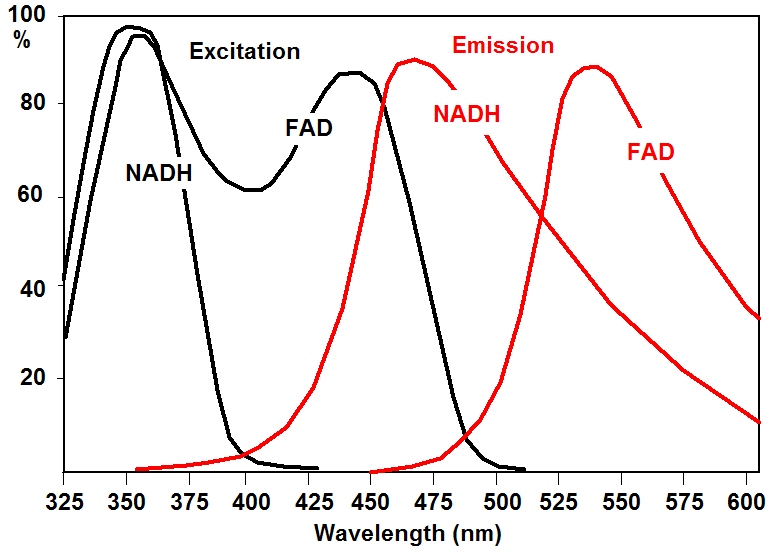
NADH 适合的单光子激发波长为 350 至 375 nm,FAD 适合的单光子激发波长为 405 至 420 nm。双光子激发波长分别为 750 纳米和 920 纳米。NAD(P)H 的检测波长间隔约为 425 至 475 nm,FAD 的检测波长间隔约为 475 至 600 nm。
同时测量 NAD(P)H 和 FAD
为了最大限度地减少光漂白、聚焦漂移和可能的生理变化的影响,最好能准同时记录 NAD(P)H 和 FAD 的 FLIM 数据。这可以通过激光复用和复用 TCSPC 来实现:激光与扫描仪同步复用,或逐行复用,或逐帧复用。两个平行的 FLIM 通道记录两个发射波长区间的信号。所有所需的功能都在bh DCS-120 共焦扫描 FLIM 系统中实现。因此,使用 DCS-120进行代谢 FLIM 只需使用正确的激光器和选择正确的设置参数。如果使用正确的激光器并为多路复用做好准备,原则上也可以使用与其他激光扫描显微镜相连的bh FLIM 系统进行代谢FLIM。
典型结果
下图是使用DCS-120 系统和波长分别为 375 nm 和 405 nm 的BDL-SMN 激光器记录的图像。激光逐帧复用,图像记录在DCS-120 系统的两个通道中。
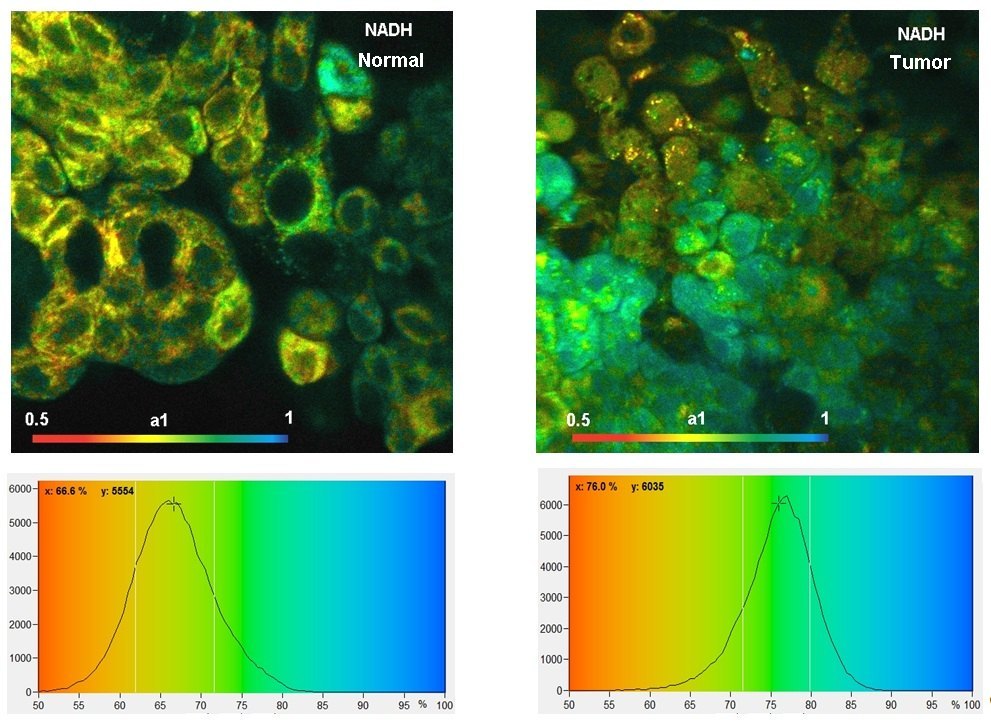
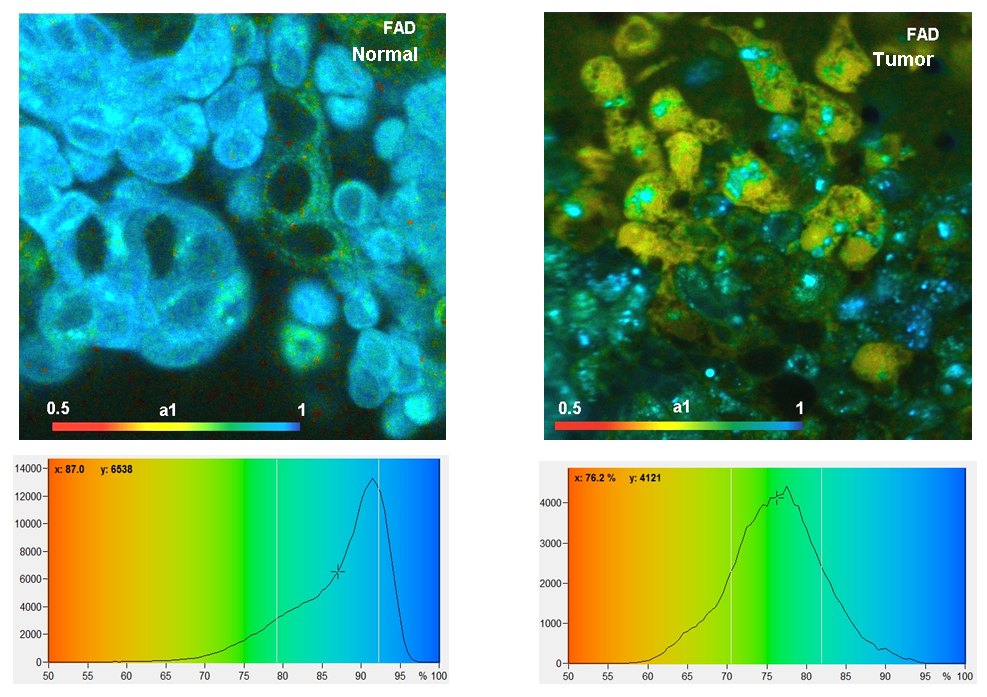
上述数据表明,正常细胞和肿瘤细胞在 NAD(P)H 和 FAD 图像中的快速衰变分量 a1 的振幅分布是不同的。更多信息,请参阅bh TCSPC 手册和应用说明 “使用 DCS-120 共焦 FLIM 系统进行代谢成像”:NAD(P)H 和 FAD 的同步 FLIM”。
References
代谢成像相关参考文献
更多参考文献请参见 W. Becker,The bh TCSPC Handbook.
- R.Alam, H. Wallrabe, Z. Svindrych, A. K. Chaudhary, K. G. Christopher, D. Chandra, A. Periasamy, Investigation of Mitochondrial Metabolic Response to Doxorubicin in Prostate Cancer Cells:NADH, FAD and Tryptophan FLIM Assay.科学报告 7 (2017)
- Awasthi, T. Nakabayashi, L. Li, N. Ohta, Effects of Nanosecond Pulsed Electric Field on Intracellular NADH Autofluorescence:正常细胞与癌细胞的比较。ACS Omega 2, 2916-2924 (2017)
- K.Bird , L. Yan , K. M. Vrotsos , K. E. Eliceiri , E. M. Vaughan.通过辅酶 NADH 的多光子荧光寿命成像绘制 MCF10A 人类乳腺细胞代谢图。癌症研究 65:8766-8773 (2005)
- Wolfgang Becker, Hauke Studier, Cornelia Wetzker, 超快速 HPM 探测器改进了 NAD(P)H FLIM。Proc. SPIE 10498, 1049806 (2018)
- S.Blacker., M. R. Duchen, Investigating mitochondrial redox state using NADH and NADPH autofluorescence.自由基生物学与医学》100,53-65 (2016)
- S.Blacker、Z. F. Mann、J. E. Gale、M. Ziegler、A. J. Bain、G. Szabadkai、M. R. Duchen, 使用 FLIM 分离活细胞和组织中的 NADH 和 NADPH 荧光。Nature Communications 5, 3936-1 to -6 (2014)
- S.Blacker, M. R. Duchen, Investigating mitochondrial redox state using NADH and NADPH autofluorescence.Free Radical Biology and Medicine 100, 53-65 (2016)
- Chance,吡啶核苷酸作为线粒体能量相关功能的氧需求指标。循环研究》38,I31-I38 (1976)
- Chorvat, A. Chorvatova, 光谱分辨时间相关单光子计数:表征离体心肌细胞内源性荧光的新方法。Eur.生物物理学。J. 36:73-83 (2006)
- Chorvat Jr.、S. Abdulla、F. Elzwei、A. Mateasik、A. Chrovatova,通过多维 TCSPC 筛选细胞收缩过程中的心肌细胞荧光。Proc. SPIE 6860, 686029-1 to -12 (2008)
- Chorvat, A. Chorvatova, 多波长荧光寿命光谱:研究活细胞和组织内源性荧光的新方法。Laser Phys.6 175-193 (2009)
- Chorvat Jr.、A. Mateasik、Y.g Cheng、N.y Poirier、J. Miro、N.S. Dahdah3、A. Chorvatova,通过多波长 NAD(P)H 荧光寿命光谱的成分分析评估移植心脏患者的排斥反应。J. Biophotonics 3 646-652 (2010)
- Chorvatova、F. Elzwiei、A. Mateasik、D. Chorvat,《通过内源性 NAAD(P)H 荧光的时间分辨光谱评估乌巴因对活心肌细胞代谢氧化状态的影响》。J. Biomed.17(10) 101505-1 to -7 (2012)
- Chorvatova、S. Aneba、A. Mateasik、D. Chorvat Jr.、B. Comte,活体心肌细胞中 4-hydroxynonenal 对内源性 NAD(P)H 影响的时间分辨荧光光谱学研究。J. Biomed.18(6), 067009-1 to -11 (2013)
- Chorvatova, A. Mateasik, D. Chorvat Jr, 活体心脏细胞中多波长荧光寿命光谱记录的 NAD(P)H 荧光成分的光谱分解。Laser Phys.10 125703-1 to -10 (2013)
- Chorvatova, 心血管系统生理和病理的自发荧光辅助检查。见:A. A. Heikal 和 V. Ghukasyan 编著,《细胞代谢的天然生物标记物》:生物学、技术与应用》。CRC Press, Taylor & Francis Group, Boca Raton, London, New York (2015)
- Cheng, D. Chorvat, N. Poirier, J. Miro, N. Dahdah, A. Chorvatova, 人体活检心肌细胞中 NAD(P)H 自发荧光的光谱和时间分辨研究。Proc. SPIE 6771, 677104-1 to -13 (2007)
- Ghukassian, F.-J. Kao, 用还原型烟酰胺腺嘌呤二核苷酸的荧光寿命监测细胞代谢。J. Phys.C, 113, 11532-11540 (2009)
- Ghukasyan,C.C. Hsu,C.R. Liu,F.J. Kao,T.H. Cheng,Fluorescence lifetime dynamics of enhanced green fluorescent protein aggregates with expanded polyglutamine.J. Biomed.15(1) 016008-1 to -11 (2010)
- V.Ghukasyan, A.H. Heikal, Natural biomarkers for cellular metabolism.生物学、技术和应用。CRC Press, Taylor and Francis Group, Boca Raton, London, New York (2015)
- Heikal,细胞内辅酶作为代谢活动和线粒体异常的天然生物标记物。Biomark.Med.4(2), 241-263 (2010)
- Kalinina, V. Shcheslavskiy, W. Becker, J. Breymayer, P. Schäfer, A. Rück, Correlative NAD(P)H-FLIM and oxygen sensing-PLIM for metabolic mapping.J. Biophotonics 9(8):800-811 (2016)
- R.Kantelhardt、J. Leppert、J. Krajewski、N. Petkus、E. Reusche、V. M. Tronnier、G. Hüttmann、A. Giese,通过时间分辨多光子激发显微镜活体成像脑和脑肿瘤标本。神经肿瘤学》,2007 年 4 月,103-112 页
- Lukina、A. Orlova、M. Shirmanova、D. Shirokov、A. Pavlikov、A. Neubauer、H. Studier、W. Becker、E. Zagaynova、T. Yoshihara、S. Tobita、V. Shcheslavskiy,《利用光纤发光寿命光谱探测肿瘤的代谢和氧状态》。Optics Letters42(4) 731-734 (2017)
- Marcek Chorvatova, 活体心肌细胞中 NAD(P)H 的时间分辨光谱学。In:W. Becker (ed.) Advanced time-correlated single photon counting applications.Springer, Berlin, Heidelberg, New York (2015)
- V.Meleshina, V. V. Dudenkova, M. V. Shirmanova, V. I. Shcheslavskiy, W. Becker, A. S. Bystrova, E.a I. Cherkasova, E. V. Zagaynova, Probing metabolic states of differentiating stem cells using two-photon FLIM.科学报告》6,21853-1 至 11 (2016)
- V.Meleshina, V. V. Dudenkova, A. S. Bystrova, D. S. Kuznetsova, M. V. Shirmanova, E. V. Zagaynova, 双光子 FLIM of NAD(P)H and FAD in mesenchymal stem cells undergoing either osteogenic or chondrogenic differentiation.干细胞研究与治疗》8,15-1 至 -10 (2017)
- N.Pastore, H. Studier, C.S. Bonder, M.S. Roberts, 黑色素瘤进展的无创代谢成像。Exp.Dermatol.26, 607-614 (2017)
- Patalay, C. Talbot, Y. Alexandrov, I. Munro, M. A. A. Neil, K. König, P. M. W. French, A. Chu, G. W. Stamp, C. Dunsby, Quantification of cellular autofluorescence of human skin using multiphoton tomography and fluorescence lifetime imaging in two spectral detection channels.Opt.Expr.2, 3295-3308 (2011)
- D.Peltan, A.V. Thomas, I. Mikhailenko, D. K. Strickland, B. T. Hyman, C.A.F. von Arnim, Fluorescence lifetime imaging microscopy (FLIM) detects stimulus-dependent phospholylation of the low density lipoprotein receptor-related protein (LRP) in primary neurons.Biochem.Biochem.Res. Commun.349, 24-30 (2006)
- Rück、C. Hauser、S. Mosch、S. Kalinina,光谱解析荧光寿命成像研究恶性和非恶性口腔黏膜细胞的新陈代谢。J. Biomed.19(9), 096005-1 to -9 (2014)
- Y.Sanchez、T.W. Prow、W.H. Sanchez、J.E. Grice、M.S. Roberts,通过多光子断层扫描和荧光寿命成像显微镜(MPT-FLIM)对细胞内 NAD(P)H 的成像,分析缺血性坏死引起的活体外皮肤代谢恶化。J. Biomed.15, 046008 (2010)
- Y.Sanchez、C. Obispo、E. Ryan、J. E. Grice、M.S. Roberts,通过多光子断层成像和荧光寿命成像测量人体皮肤因内在和光诱导老化引起的氧化还原状态和内源性荧光变化。J. Biomed.18(6), 061217-1 to -12 (2013)
- Y.Sanchez、M. Pastore、I. Haridass、K. König、 W. Becker、M. S. Roberts,《皮肤的荧光寿命成像》。In:W. Becker (ed.) Advanced time-correlated single photon counting applications.Springer, Berlin, Heidelberg, New York (2015)
- M.Schaefer、D. Hilpert、M. Niederschweiberer、L. Neuhauser、S. Kalinina、E. Calzia、A. Rueck、B. von Einem、C.A.F. von Arnim,《线粒体基质 pH 值是神经代谢成像的决定性因素》。神经光子学 4(4):045004 (2017)
- M.Schaefer、S. Kalinina、A. Rueck、C.A.F. von Arnim、B. von Einem,《NADH 自发荧光–促进生物能研究的标记》。Cytometry Part A, 1-13 (2018)
- Schweitzer, S. Schenke, M. Hammer, F. Schweitzer, S. Jentsch, E. Birckner, W. Becker, Towards Metabolic Mapping of the Human Retina.Micr.Micr.70, 403-409 (2007)
- F.Sergeeva、M. V. Shirmanova、O. A. Zlobovskaya、A. I. Gavrina、V. V. Dudenkova、M. M. Lukina、K. A. Lukyanov、E. V. Zagaynova, 癌细胞凋亡过程中细胞内 pH 值、代谢辅因子和 caspase-3 激活之间的关系。BBA – 分子细胞研究(2017)
- V.Shirmanova、I. N. Druzhkova、M. M. Lukina、V. V. Dudenkova、N. I. Ignatova、L. B. Snopova、V. I. Shcheslavskiy、V. V. Belousov、E. V. Zagaynova,《顺铂化疗:体外和体内癌细胞胞内pH值和代谢状况的见解》。科学报告 7,8911-1 至 -11
- I.Shcheslavskiy、M. V. Shirmanova、V. V. Dudenkova、K. A. Lukyanov、A. I. Gavrina、A. V. Shumilova、E. Zagaynova、W. Becker,荧光时间分辨宏观成像。Opt.Lett.43, No. 13, 3152-5155 (2018)
- C.Skala、K. M. Riching、D. K. Bird、A. Dendron-Fitzpatrick、J. Eickhoff、K. W. Eliceiri、P. J. Keely、N. Ramanujam, 正常和癌前上皮细胞中蛋白结合和游离烟酰胺腺嘌呤二核苷酸的体内多光子荧光寿命成像。J. Biomed.12 02401-1 to 10 (2007)
- C.Skala、K. M. Riching、A. Gendron-Fitzpatrick、J. Eickhoff、K. W. Eliceiri、J. G. White、N. Ramanujam,癌前上皮细胞中 NADH 和 FAD 氧化还原状态、荧光寿命和细胞形态的活体多光子显微镜,PNAS 104,19494-19499(2007 年)。
- C.Skala, A. Fontanella, L. Lan, J.A. Izatt, M.W. Dewhirst, Longitudinal optical imaging of tumor metabolism and hemodynamics.J. Biomed.15(1) 011112-1 to -8 (2010)
- C.Skala, N. Ramanujam, 用于体内代谢监测的多光子氧化还原比率成像。Methods Mol.594, 155-162 (2010)
- Wallrabe、Z. Svindrych、S. R. Alam、K. H. Siller、T. Wang、D. Kashatus、S. Hu、A. Periasamy,通过 FLIM 测量癌细胞中自发荧光 NAD(P)H、FAD 和 Trp 的氧化还原状态的分段细胞分析。科学报告 8:79, 1-11 (2018)
- 计算、计算与控制。IEE Computing and Control Engineering Journal 12, 157-168 (2001)
- Walsh、R.C. Cook、B. Rexer、C.L. Arteaga、M.C. Skala,HER2 过度表达乳腺癌细胞代谢的光学成像。生物医学光学快报》3(1),75-85 (2012)
- J.Walsh, R. S. Cook, H. C. Manning, D. J. Hicks, A. Lafontant, C. L. Arteaga, M. C. Skala, Optical Metabolic Imaging Identifies Glycolytic Levels, Subtypes, and Early-Treatment Response in Breast Cancer.Cancer Res. 73, 6164-6174 (2013)
- J.Walsh, R. S. Cook, M. E. Sanders, L. Aurisicchio, G. Ciliberto, C. L. Arteaga, M. C. Skala, Quantitative Optical Imaging of Primary Tumor Organoid Metabolism Predicts Drug Response in Breast Cancer.Cancer Res 74, OF1-OF11 (2014)
- J.Walsh, A. T. Shah, J. T. Sharick, M. C. Skala, 活细胞和组织中 NADH 的荧光寿命测量。In:W. Becker (ed.) Advanced time-correlated single photon counting applications.Springer, Berlin, Heidelberg, New York (2015)
- J.Walsh, M. C. Skala, 光学代谢成像量化异质细胞群。Biomed.Opt.Expr.6, 559-573 (2015)
- H-W. Wang, V. Ghukassass.Wang, V. Ghukassyan, C.T. Chen, Y.H. Wei, H.W. Guo, J.S. Yu, F.J. Kao, 通过活细胞中还原烟酰胺腺嘌呤二核苷酸荧光寿命的动态变化区分细胞凋亡和坏死。J. Biomed.13(5), 054011-1 to 9 (2008)
- Wang, R. Zhang, K. R. Bridle, A. Jayachandran, J. A. Thomas, W. Zhang, J. Yuan, Z. P. Xu, D. H. G. Crawford, X. Liang, X. Liu, M. S. Roberts, 用于体内监测肝损伤中细胞氧化应激的双光子成像平台。科学报告》7,45374-1 至 -11 (2017)
- Yuzhakova D, Kiseleva E, Shirmanova M, Shcheslavskiy V, Sachkova D, Snopova L, Bederina E, Lukina M, Dudenkova V, Yusubalieva G, Belovezhets T, Matvienko D, Baklaushev V. Highly Invasive Fluorescent/Bioluminescent Patient-Derived Orthotopic Model of Glioblastoma in Mice.Front Oncol.doi: 10.3389/fonc.2022.897839.
- W.Becker, R. Suarez-Ibarrola, A. Miernik, L. Braun, Metabolic Imaging by Simultaneous FLIM of NAD(P)H and FAD.生物医学工程的当前方向 5(1),1-3(2019 年)
- M.M. M. Lukina, L. E. Shimolina, N. M. Kiselev, V. E. Zagainov, D. V. Komarov, E. V. Zagaynova, M. V. Shirmanova, Interrogation of tumor metabolism in tissue samples ex vivo using fluorescence lifetime imaging of NAD(P)H. Methods Appl.Methods Appl.8, 014002, 1-11 (2020)
- M.Lukina, K. Yashin, E. E. Kiseleva, A. Alekseeva, Varvara Dudenkova, E. V. Zagaynova, E. Bederina, I. Medyanic, W. Becker, D. Mishra, M. Berezin, V. I. Shcheslavskiy, M. Shirmanova, Label-Free Macroscopic Fluorescence Lifetime Imaging of Brain Tumors.Frontiers in Oncology 11, 666059, 1-11 (2021)
- R.Suarez-Ibarrola, L. Braun, P. Fabian Pohlmann, W. Becker, A. Bergmann, C. Gratzke, A. Miernik, K. Wilhelm, Metabolic Imaging of Urothelial Carcinoma by Simultaneous Autofluorescence Lifetime Imaging (FLIM) of NAD(P)H and FAD.临床泌尿生殖系统癌症(2020年)
