CONTACT US
Principles
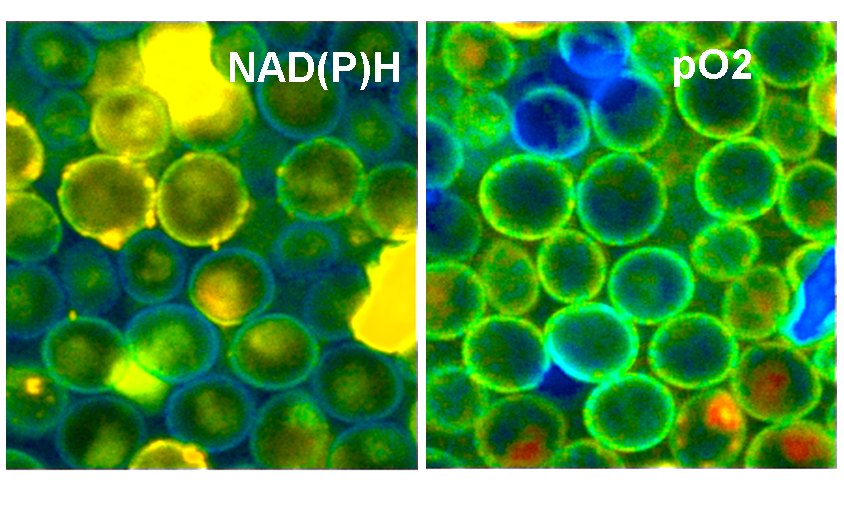
NAD(P)H 和 pO2 同步成像
NAD(P)H 的荧光衰减函数是细胞正在进行氧化(氧化磷酸化)还是还原代谢(糖酵解)的指标。变化的根源在于结合和非结合 NAD(P)H 比例的变化。结合和未结合的部分具有不同的荧光寿命,这反过来又导致衰变曲线的变化,见下图。
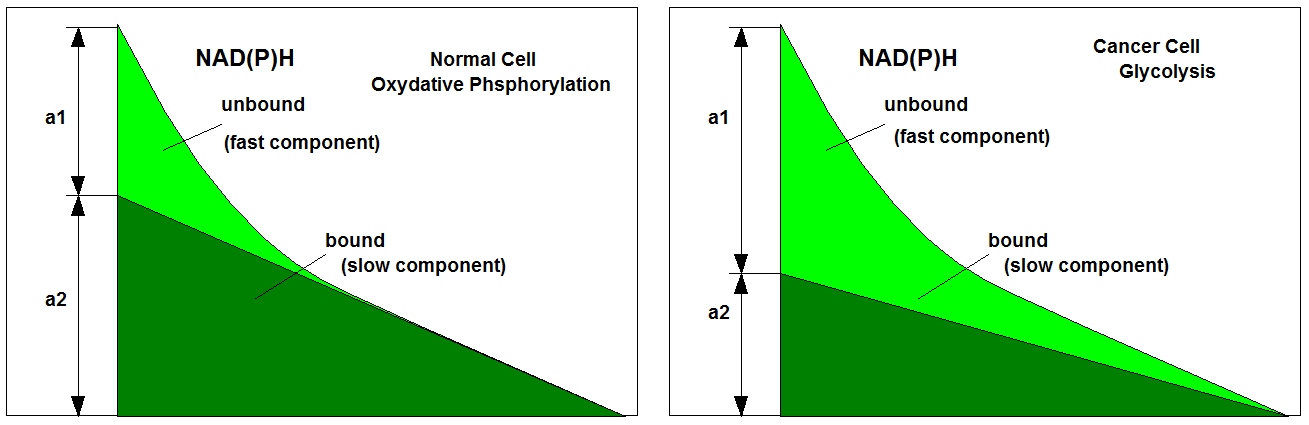
在健康细胞中,新陈代谢主要是氧化性的,而在癌细胞中则是还原性的。因此,衰减曲线的形状,特别是 a1/a2 比率,是区分正常细胞和癌细胞的一个参数。新陈代谢成像》一书中阐述了衰变曲线的变化。不幸的是,新陈代谢状态也会随着供氧量的变化而变化。在缺氧条件下,正常细胞的新陈代谢可能会转向糖酵解,表现与癌细胞相似。因此,最好有一种技术能在 NAD(P)H FLIM 过程中跟踪氧浓度(或氧分压,pO2)。
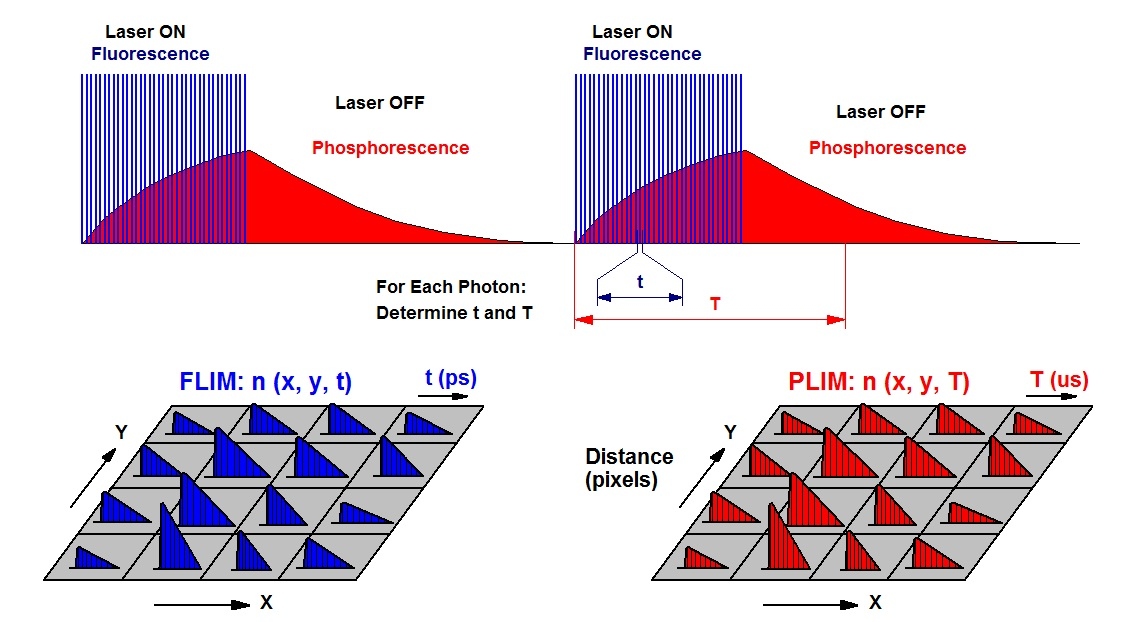
bh 的同步 FLIM / PLIM 技术可同时记录 NAD(P)H 荧光和氧传感器的磷光。该技术基于对激发脉冲序列的额外调制,并建立两个光子分布。FLIM 分布来自激发脉冲周期内的光子时间,PLIM 分布来自调制周期内的光子时间。原理如下图所示。
下图是一个典型的结果。酵母细胞用钌基磷光染料染色。然后通过上述 FLIM/PLIM 过程对细胞进行成像。
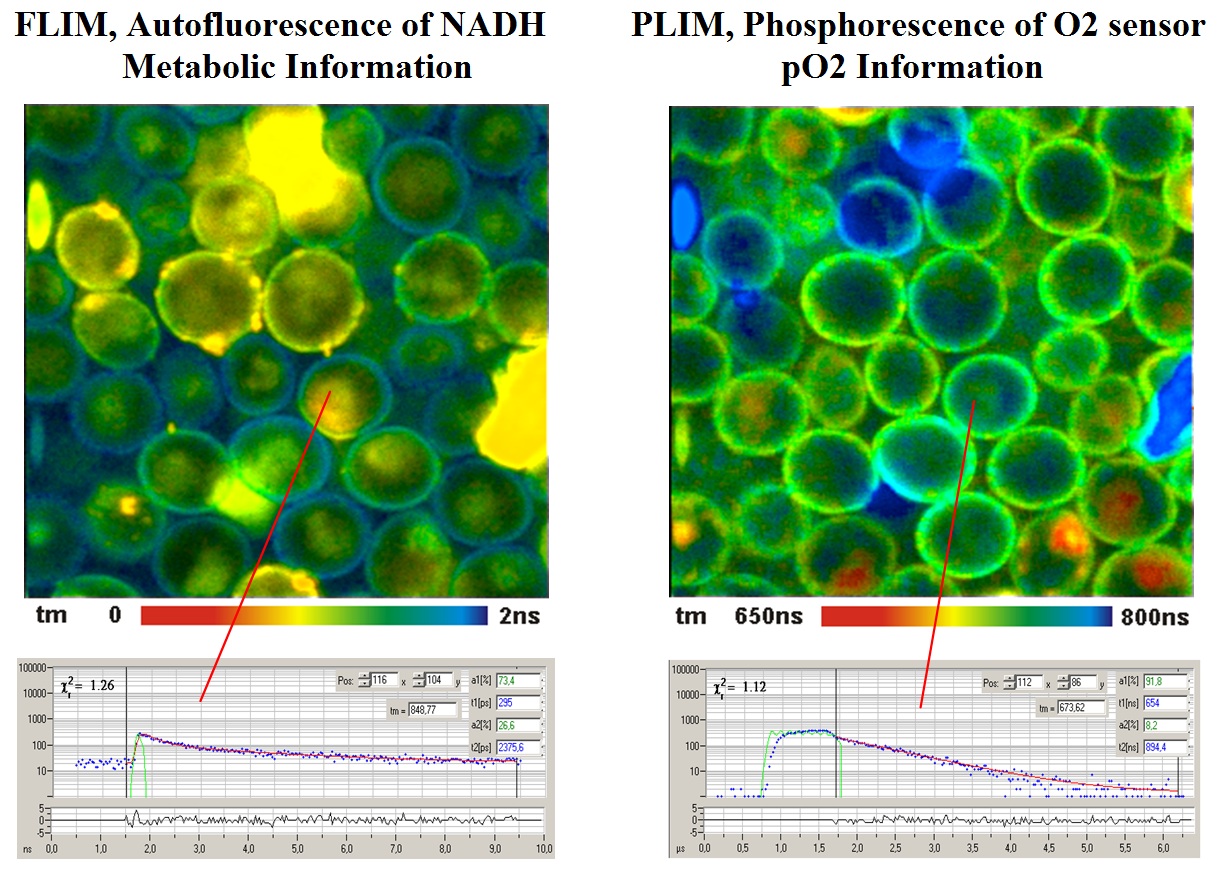
详情请参见bh TCSPC 手册“磷光寿命测量的氧传感 “一章。
References
与同步 FLIM/PLIM 相关的出版物
- Baggaley, S. W. Botchway, J. W. Haycock, H. Morris, I. V. Sazanovich, J. A. G. Williams, J. A. Weinstein, Long-lived metal complexes open up microsecond lifetime imaging microscopy under multiphoton excitation: from FLIM to PLIM and beyond.Chem.5, 879-886 (2014)
- Baggaley, M. R. Gill, N. H. Green, D. Turton, I. V. Sazanovich, S. W. Botchway, C. Smythe, J. W. Haycock, J. A. Weinstein, J. A. Thomas, Dinuclear Ruthenium(II) Complexes as Two-Photon, Time-Resolved Emission Microscopy Probes for Cellular DNA.Angew.Chem.Int.Ed.53, 3367-3371 (2014)
- Becker, B. Su, A. Bergmann, K. Weisshart, O. Holub, 同步荧光和磷光寿命成像。Proc. SPIE 7903, 790320 (2011)
- Becker,荧光寿命成像技术:时间相关单光子计数。见 L. Marcu:L. Marcu.P.M.W. French, D.S. Elson, (eds.), Fluorescence lifetime spectroscopy and imaging.生物医学诊断原理与应用》。CRC Press, Taylor & Francis Group, Boca Raton, London, New York (2015)
- Becker, V. Shcheslavskiy, A. Rück, 通过多维 TCSPC 和多脉冲激发同时进行磷光和荧光寿命成像。In:R. I. Dmitriev(编辑),三维组织模型的多参数活细胞显微学。Springer (2017)
- Becker,通过多维时间相关单光子计数进行荧光寿命成像。Medical Photonics 27, 41-61 (2015)
- Becker, Introduction to Multi-Dimensional TCSPC.见 W. Becker(编)《高级时间相关单光子计数应用》。Springer, Berlin, Heidelberg, New York (2015)
- Becker & Hickl GmbH,DCS-120 共焦扫描 FLIM 系统,用户手册。第 6 版(2015 年),见 www.becker-hickl.com
- Becker & Hickl GmbH,用于蔡司 LSM 710 / 780 / 880 激光扫描显微镜的模块化 FLIM 系统。第 6 版(2015 年),请访问 Becker-Hickl.com。
- I.Dmitriev, A. V. Zhdanov, Y. M. Nolan, D. B. Papkovsky, Imaging of neurosphere oxygenation with phosphorescent probes.生物材料 34, 9307-9317 (2013)
- I.Dmitriev、A. V. Kondrashina、K. Koren、I. Klimant、A. V. Zhdanov、J. M. P. Pakan、K. W. McDermott、D. B. Papkovsky,用于三维组织模型中氧气成像的小分子磷光探针。Biomater.2, 853-866 (2014)
- Jenkins, R. I. Dmitriev, D. B. Papkovsky, 通过 TCSPC-PLIM 对细胞和组织进行氧气成像。In:W. Becker (ed.) Advanced time-correlated single photon counting applications.Springer, Berlin, Heidelberg, New York (2015)
- Kalinina, V. Shcheslavskiy, W. Becker, J. Breymayer, P. Schäfer, A. Rück, Correlative NAD(P)H-FLIM and oxygen sensing-PLIM for metabolic mapping.J. Biophotonics 9(8):800-811 (2016)
- Kurokawa、H. Ito、M. Inoue、K. Tabata、Y. Sato、K. Yamagata、S. Kizaka-Kondoh、T. Kadonosono、S. Yano、M. Inoue & T. Kamachi,利用磷光寿命对细胞内氧浓度进行高分辨率成像,《科学报告》5,1-13 (2015)
- Lukina、A. Orlova、M. Shirmanova、D. Shirokov、A. Pavlikov、A. Neubauer、H. Studier、W. Becker、E. Zagaynova、T. Yoshihara、S. Tobita、V. Shcheslavskiy,利用基于光纤的发光寿命光谱探测肿瘤的代谢和氧状态。Optics Letters42(4) 731-734 (2017)
- I.Shcheslavskiy, A. Neubauer, R. Bukowiecki, F. Dinter, W. Becker, Combined fluorescence and phosphorescence lifetime imaging.Appl.108, 091111-1 to -5 (2016)
- Shibata, S. Ichioka, J. Ando, A. Kamiya, 通过磷光淬灭测量大鼠骨骼肌的微血管和间质 PO2。J. Appl. Physiol.
- Toncelli, O. V. Arzhakova, A. Dolgova, A. L. Volynskii, N. F. Bakeev, J. P. Kerry, D. B. Papkovsky, Oxygen-sensitive phosphorescent nanomaterials produced from high density polyethylene films by local solvent-crazing.Anal.Chem.86(3), 1917-23 (2014)
- V.Zhdanov, A. V. Golubeva, I. A. Okkelman, J. F. Cryan, D. B. Papkovsky, Imaging of oxygen gradients in giant umbrella cells: an ex vivo PLIM study.Am J Physiol Cell Physiol 309: C000-C000, 2015
