Principles
目录
佛斯特共振能量转移 (FRET) – 探索蛋白质与蛋白质之间的相互作用
佛斯特共振能量转移(FRET)是两个分子之间的相互作用,其中一个分子的发射带与另一个分子的吸收带重叠。在这种情况下,第一个分子(供体)的能量可以转移到第二个分子(受体)。FRET 可以极其有效地淬灭供体荧光,从而大大降低供体的寿命。从供体到受体的能量传输率随距离的六次方而降低。因此,只有在距离小于 10 纳米时,这种现象才会明显。FRET 被用作研究蛋白质间相互作用的工具。供体和受体分别标记不同的蛋白质,FRET 用作这些蛋白质之间结合的指标。FRET 是最常见的FLIM应用。
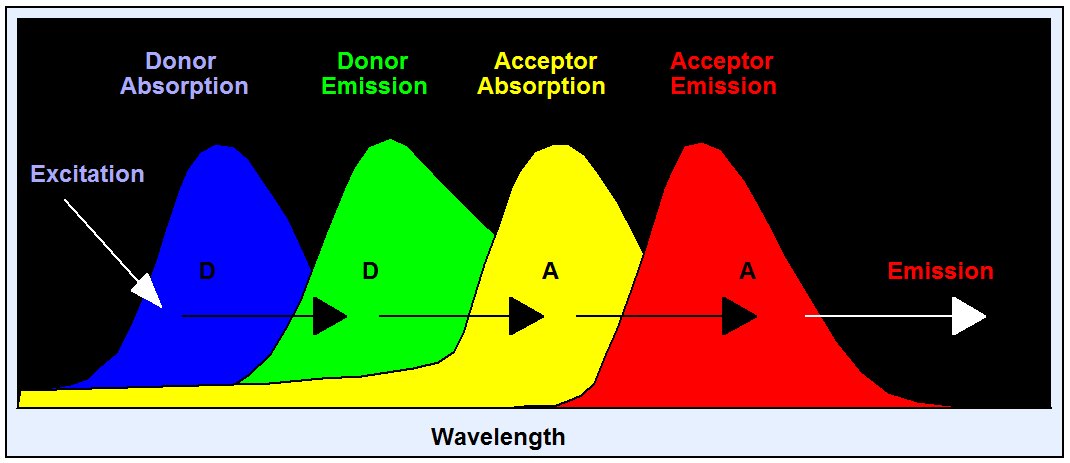
由于其对距离的依赖性,FRET 已成为细胞生物学的重要工具。用供体和受体标记不同的蛋白质;然后利用 FRET 验证蛋白质是否存在物理连接,并确定纳米级的距离。
利用 FLIM-FRET了解蛋白质相互作用:如何解读数据和可视化结果
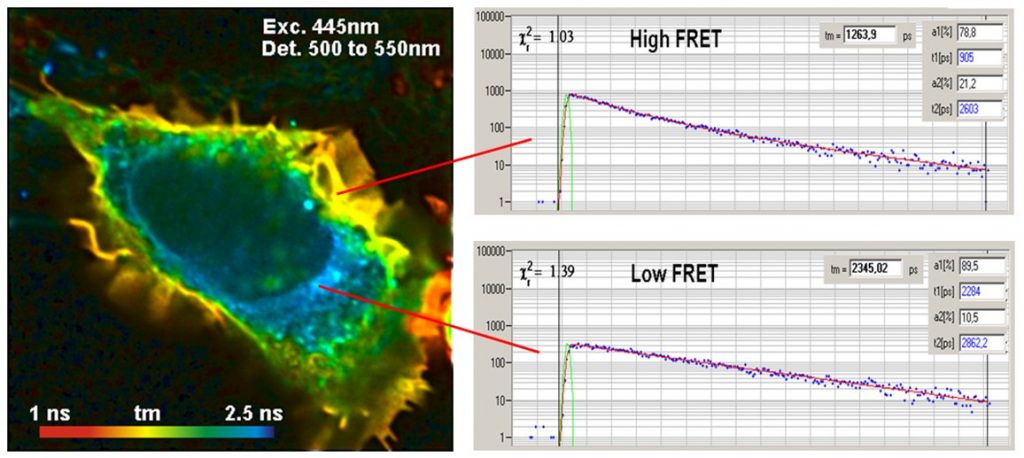
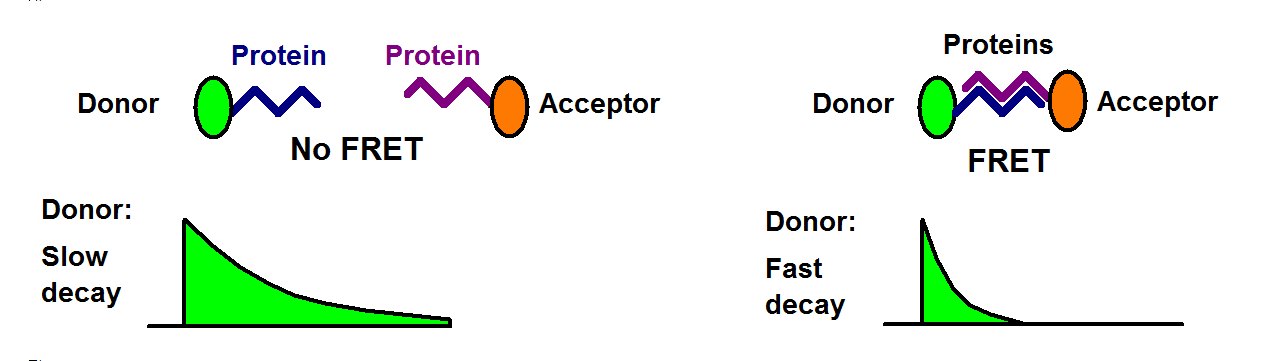
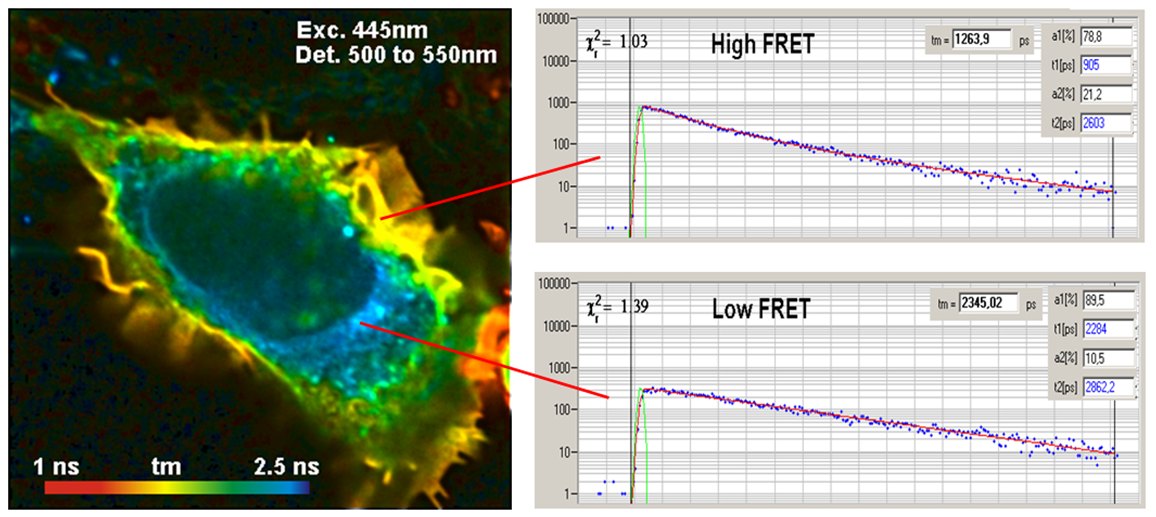
FLIM-FRET 数据的解读很简单:在没有 FRET 的情况下,供体的寿命保持不变。当存在 FRET 时,供体会将其激发能量释放到受体中,因此寿命会缩短,见下图。
使用FLIM进行 FRET 有一个明显的好处,即可以从供体的单个寿命图像中获得 FRET 强度。发生 FRET 时,供体的荧光寿命会缩短,而没有 FRET 时,供体的荧光寿命保持不变。检测蛋白质相互作用所需的就是供体的单个荧光寿命图像。因此,供体渗漏和直接激发的受体荧光对 FLIM-FRET 测量没有影响。下图是一个例子。
双指数 FLIM-FRET 分析 – 精确测量距离
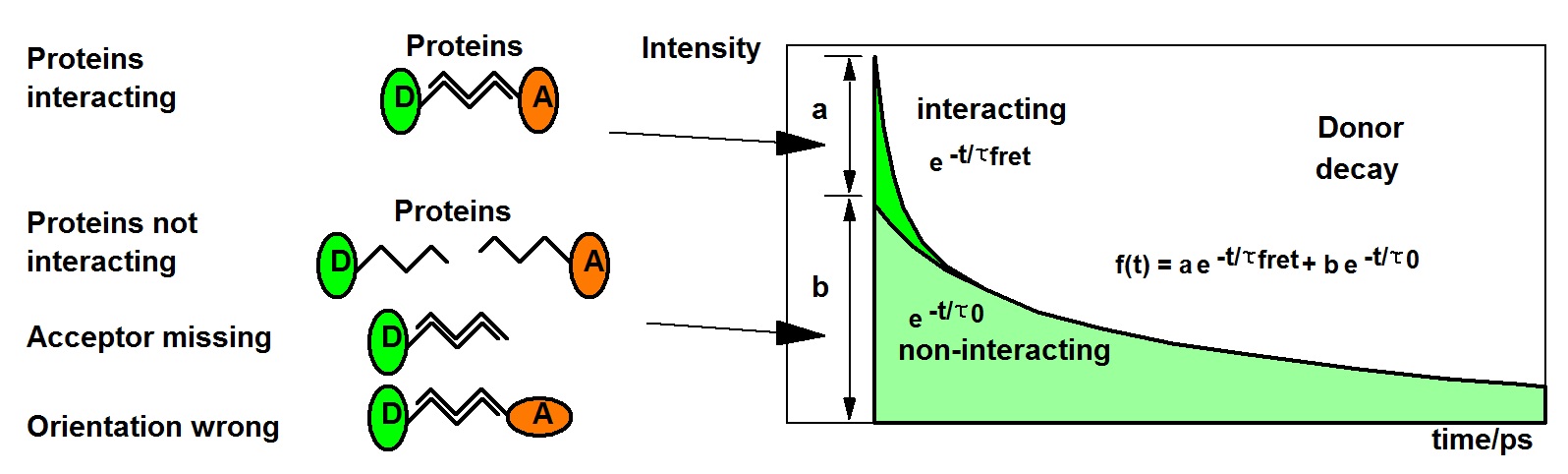
在所有蛋白质相互作用实验中,通常存在相互作用蛋白质和非相互作用蛋白质的混合物。相互作用蛋白质的比例和蛋白质之间的距离都会影响从强度得出的净 FRET 效率。因此,无法判断 FRET 效率的变化是由于距离的变化还是由于相互作用蛋白质比例的变化。
TCSPC FLIM 通过双指数寿命分析解决了相互作用和非相互作用供体的问题。由此得出的供体衰变函数可近似为双指数模型,其中快速部分来自相互作用的供体分子,慢速寿命部分来自非相互作用的供体分子。供体不相互作用有多种原因。蛋白质可能只是没有相互连接,受体蛋白质可能没有被受体标记,或者供体和受体之间的方向可能是错误的。方向通常被认为是随机的,并通过κ2因子加以考虑。如果细胞表达的是 GFP 变体的融合蛋白,那么衰减分量代表了相互作用和非相互作用供体分子的比例。经κ2 校正后,振幅 a 和 b 代表相互作用和非相互作用蛋白质分子的比例。供体衰变函数的组成如下图所示。
下图显示了双指数 FLIM-FRET 分析的结果。左图显示了非相互作用和相互作用供体部分的寿命比t0/ tfret。最左侧显示的是t0/tfret 在不同区域的分布情况。最大值的位置仅相差 10%,相当于约 2%的距离变化。然而,强度系数 a/b 以及相互作用蛋白质的比率Nfret/N0的变化约为 10:1。
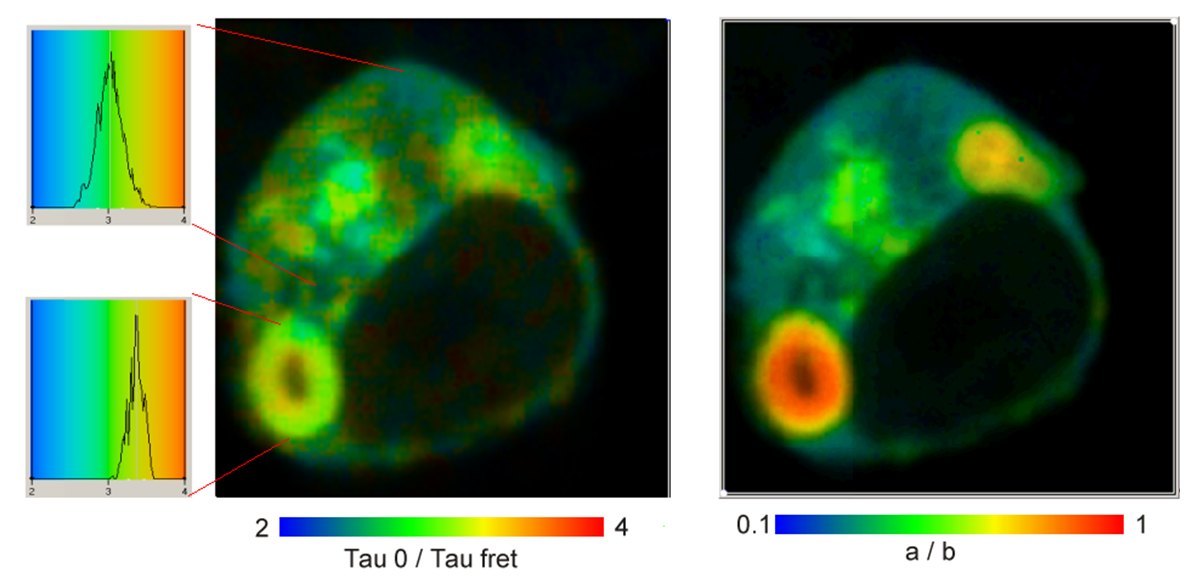
结果清楚地表明,单指数寿命的变化几乎完全是由相互作用蛋白质比例的变化引起的,而不是由供体-受体距离的变化引起的。换句话说,将单指数寿命的变化(或稳态实验中经典的 FRET 效率!)解释为距离变化会导致错误的结论。因此,双指数 FRET 分析是向定量 FRET 实验迈出的重要一步。
欲了解更多信息和参考文献,请参阅bh TCSPC Handbook,Förster Resonance Energy Transfer (FRET) 一章。
References
FRET 成像参考文献
有关 FLIM-FRET 的更多参考资料,请参阅 bh TCSPC 手册 “Förster Resonance Energy Transfer (FRET) “一章。
- Ahmed, R. George, C.-C. Lin, K. M. Suen.Lin、K. M. Suen、J. A. Levitt、K. Suhling、J. E. Ladbury,Grb2 SH3 结构域与 FGFR2 的直接结合调节 SHP2 的功能。细胞信号 22 23-33 (2010)
- Ahmed, Z. Timsah, K. M. Suen, N. P. Cook, G. R. Lee, Chi-Chuan Lin, Mihai Gagea, A. A. Marti, J.n E. Ladbury, Grb2单体-二聚体平衡决定正常与致癌功能。自然通讯》6,7354-1 至 -9
- R.Alam, H. Wallrabe, Z. Svindrych, A. K. Chaudhary, K. G. Christopher, D. Chandra, A. Periasamy, Investigation of Mitochondrial Metabolic Response to Doxorubicin in Prostate Cancer Cells:NADH, FAD and Tryptophan FLIM Assay.科学报告 7 (2017)
- Amari, E. Boutant, C. Hofmann, C. Schmitt-Keichinger, L. Fernandez-Calvino, P. Didier, A. Lerich, J. Mutterer, C. L. Thomas, M. Heinlein, Y. Mely, A. J. Maule, C. Ritzenthanler, A family of plasmodesmal proteins with receptor-like properties for plant viral movement proteins.PLOS Pathogens 6 e1001119-1 to -10 (2010)
- Aow, K. Dore, R. Malinow, NMDA受体复合物突触可塑性所需的构象信号。PNAS 早期版,www.pnas.org/cgi/doi/10.1073/pnas.1520029112
- J.Bacskai, J. Skoch, G.A. Hickey, R. Allen, B.T. Hyman, Fluorescence resonance energy transfer determinations using multiphoton fluorescence lifetime imaging microscopy to characterize amyloid-beta plaques, J. Biomed.Opt8, 368-375 (2003)
- J.Bacskai、J. Skoch、G.A. Hickey、O. Berezovska、B.T. Hyman,阿尔茨海默病小鼠模型的多光子成像,Proc. SPIE,5323,71-76(2004 年)
- Becker, K. Benndorf, A. Bergmann, C. Biskup, K. König, U. Tirlapur, T. Zimmer, 通过 TCSPC 激光扫描显微镜进行 FRET 测量,Proc. SPIE4431, 94-98 (2001)
- Becker、A. Bergmann、M.A. Hink、K. König、K. Benndorf、C. Biskup,通过时间相关单光子计数进行荧光寿命成像,Micr.Res. Techn.63, 58-66 (2004)
- Berezovska、P. Ramdya、J. Skoch、M.S. Wolfe、B.J. Bacskai、B.T. Hyman,荧光寿命成像显示淀粉样蛋白前体与细胞中预蛋白 1-g-分泌酶复合物上的尼古丁依赖性对接位点相关联,J. Neurosci.23, 4560-4566 (2003)
- Berezovska, B.J. Bacskai, B.T. Hyman, Monitoring Proteins in Intact Cells, Science of Aging Knowledge Environment, SAGE KE 14 (2003)
- Berezovska、A. Lleo、L.D. Herl、M.P. Frosch、E.A. Stern、B.J. Bacskai、B.T. Hyman,家族性阿尔茨海默病预褪色素 1 突变导致预褪色素构象改变以及与淀粉样前体蛋白的相互作用,J. Neurosci.25, 3009-3017 (2005)
- Biskup、L. Kelbauskas、T. Zimmer、K. Benndorf、A. Bergmann、W. Becker、J.P. Ruppersberg、C. Stockklausner、N. Klöcker,通过基于荧光寿命的共振能量转移成像观察 PSD-95 与钾通道的相互作用,J. Biomed.9, 735-759 (2004)
- Biskup, T. Zimmer, L. Kelbauskas, B. Hoffmann, N. Klöcker, W. Becker, A. Bergmann, K. Benndorf, 多维荧光寿命和 FRET 测量。Micr.Res.Tech。70, 403-409 (2007)
- Bosch、J. Castro、T. Saneyoshi、H. Matsuno、M. Sur、Y. Hayashi, Long-Term Potentiation 期间树突棘下部结构的结构和分子重塑。Neuron 82, 12059-1 to -16 (2014)
- Calleja, S. Ameer-Beg, B. Vojnovic, R. Woscholski, J. Downwards, B. Larijani, Monitoring conformational changes of proteins in cells by fluorescence lifetime imaging microscopy, Biochem.J.372, 33-40 (2003)
- Chen, A. Periasamy, Characterization of two-photon excitation fluorescence lifetime imaging microscopy for protein localization, Microsc.Res. Tech.63, 72-80 (2004)
- Cheung, M. Gill, A. Esposito, C. F. Kaminski, N. Courousse, S. Chwetzoff, G. Trugnan, N. Keshavan, A. Lever, U. Desselberger, Rotaviruses Associate with Cellular Lipid Droplet Components To Replicate in Viroplasms, and Compounds Disrupting or Blocking Lipid Droplets Inhibit Viroplasm Formation and Viral Replication. J. Virol.J. Virol.84, 6782-6798 (2010)
- N.Day、C.F. Booker、A. Periasamy,用于福斯特共振能量转移显微镜的改进型供体荧光蛋白的特性。J. Biomed.13(3), 031203-1 to -9 (2008)
- N.Day, F. Schaufele, 用于研究活细胞中蛋白质动态的荧光蛋白工具:J. Biomed.J. Biomed.13(3), 031202-1 to -6 (2008)
- Dore, S. Labrecque, C. Tardif, P. De Koninck, FRET-FLIM Investigation of PSD95-NMDA Receptor Interaction in Dendritic Spines; Control by Calpain, CaMKII and Src Family Kinase.PLOS ONE 9(11), e112170 (2014)
- Dore、J. Aow、R. Malinow, NMDA受体的激动剂结合驱动其胞质结构域的运动而不产生离子流。美国国家科学院院刊早期版,www.pnas.org/cgi/doi/10.1073/pnas.1520023112
- R.Duncan、A. Bergmann、M.A. Cousin、D.K. Apps、M.J. Shipston,多维时间相关单光子计数(TCSPC)荧光寿命成像显微镜(FLIM)检测细胞中的 FRET,J. Microsc.215, 1-12 (2004)
- D.Ellis , D. Llères, M. Denegri , A.I. Lamond , J.F. Cáceres, Spatial mapping of splicing factor complexes involved in exon and intron definition.J. Cell Biol. 181, 921-934 (2008)
- 福斯特:《能量迁移与荧光》。Klaus Suhling 译。J. Biomed.17 011002-1 to -10 (2012)
- Fogel、S. Frere、O. Segev、S. Bharill、I. Shapira、N. Gazit、T. O’Malley、E. Slomowitz、Y. Berdichevsky、D.M. Walsh、E.Y. Isacoff、J.A. Hirsch、I. Slutsky,APP 同源二聚体在兴奋性突触中传递淀粉样β介导的释放概率增加。Cell Rep. 7 1560-1576 (2014)
- H.Fox、T. Connor、M. Stiles、J. Kama、Z. Lu、K. Dorsey、G. Lieberman、E. Sapp、R.A. Cherny、M. Banks、I. Volitakis、M. DiFiglia、O. Berezovska、A.I. Bush、S.M. Hersch, Cysteine Oxidation within N-terminal Mutant Huntingtin Promotes Oligomerization and Delayance Clearance of Soluble Protein.J. Biol.Chem.286, 18320-18330 (2011)
- O.Fruhwirth、S. Ameer-Beg、R. Cook、T. Watson、T. Ng、F. Festy,使用 TCSPC 测量活细胞中 FRET 的荧光寿命内窥镜。Opt.Expr.18, 11148-11158 (2010)
- Ghukasyan, Y.-Y.Hsu, S.-H. Kung, F.-J.Kung, F.-J. Kao, Application of fluorescence resonance energy transfer resolved by fluorescence lifetime imaging microscopy for the detection of enterovirus 71 infection in cells, J. Biomed.12, 024016-1 to -8 (2007)
- Guardia-Laguarta, M. Coma, M. Pera, J. Clarimon, L. Sereno, J.M. Agullo, L. Molina-Porcel, E. Gallordo, A. Deng, O. Berezovska, B. Hyman, R. Blesa, T. Gomez-Isla, A. Lleo, Mild cholesterol depletion reduces amyloid-b production by impairing APP trafficking to the cell surface.J. Neurochem.110, 220-230 (2009)
- Herl、A. V. Thomas、C. M. Lill、M. Banks、A. Deng、P. B. Jones、R. Spoelgen、B.y T. Hyman、O. Berezovska,淀粉样前体蛋白突变影响其与 presenilin/g-secretase 的相互作用。分子和细胞神经科学》41,166-174(2009 年)
- Ilien, N. Glasser, J.-P.Clamme, P. Didier, E. Piemont, R. Chinnappan, S. B. Daval, J.-L. Galzi, Y. Mely, Pirenzepine Promotes the Dimerization of Muscarinic M1 Receptors through a Three-step Binding Process.J. Biol.Chem.284(29) 19533-19543, (2009)
- B.Jones、K.W. Adams、A. Rozkalne、T.L. Spires-Jones、T.T. Hshieh、T. Hashimoto1、C.A. F. von Armin、M. Mielke、B.J. Bacskai、B.T. Hyman,载脂蛋白 E:人类阿尔茨海默氏症脑中三级结构和与淀粉样蛋白-b相互作用的异构体特异性差异。PLoS One 6, e14586 (2011)
- Jyothikumar、Y. Sun、A. Periasamy,利用三光子荧光寿命成像研究活人细胞中的酪蛋白-NADH。J. Biomed.18(6), 060501 (2013)
- Kwaaitaal, N.F. Keinath, Simone Pajonk, C. Biskup, R. Panstruga, 结合双分子荧光互补和佛尔斯特共振能量转移揭示活植物细胞中三元 SNARE 复合体的形成。植物生理学》152 期,1135-1147(2010 年)
- V.Koushik, H. Chen, C. Thaler, H. L. Puhl, and S. S. Vogel, Cerulean, Venus, and VenusY67C FRET Reference Standards.Biophys J.: Biophysical Letters L99-L101 (2006)
- Lleo、O. Berezovska、L. Herl、S. Raju、A. Deng、B.J. Bacskai、M.P. Frosch、M. Irizarry、B.T. Hyman,非甾体抗炎药降低 Ab42 和改变 presenilin 1 构象,《自然医学》10,1065-1066(2004 年)
- Lleres, S. Swift, A. I. Lamond, Detecting Protein-Protein Interactions In Vivo with FRET using Multiphoton Fluorescence Lifetime Imaging Microscopy (FLIM).Curr.Curr.Cytom.42, 12.10.1-12.10.19 (2007)
- Lleres, J. James, S. Swift, D.G. Norman, A. I. Lamond, 使用 FLIM-FRET 定量分析活细胞中染色质的压实。细胞生物学杂志》,187,481-191(2009 年)
- Lleres、A. P. Bailly A. Perrin、D. G. Norman、D. P. Xirodimas、R. Feil,定量 FLIM-FRET 显微镜监测体内纳米级染色质压实揭示凝集素复合物的结构作用。细胞报告》18,1791-1803 (2017)
- N.Medine, A. McDonald, A, Bergmann, R. Duncan, Time-correlated single photon counting FLIM: Some considerations for Physiologists.Micr.Micr.70, 421-425 (2007)
- L.Medintz、T. Pons、K. Susumu、K. Boeneman、A.M. Dennis、D. Farrel、J.R. Deschamps、J.S. Melinger、G. Bao、H. Mattoussi,发光量子点与不同荧光蛋白受体之间的共振能量趋势。J. Phy.Chem.C 113, 18552-18560 (2009)
- Munsie, N. Caron, R. S. Atwal, I. Marsden, E. J. Wild, J. R. Bamburg, S. J. Tabrizi, R. Truant, Mutant huntingtin causes defective actin remodeling during stress: defining a new role for transglutaminase 2 in neurodegenerative disease.人类分子遗传学》,2011 年,第 20 卷第 10 期 1937-1951
- Murakoshi, S-J.Lee, R. Yasuda, 使用改进的非辐射 YFP 对单个树突棘进行高灵敏度和定量 FRET-FLIM 成像。36, 31-42 (2008)
- Murakoshi, A.C.E. Shibata, ShadowY: a dark yellow fluorescent protein for FLIM-based FRET measurement.科学报告》7,6791-1 至 10 (2017)
- Pelet, M.J.R. Previte, P.T.C. So, 基于强度、光谱和寿命成像的福斯特共振能量转移测量精度量化比较。J. Biomed.11 034017-1 to -11 (2006)
- Periasamy、R.M. Clegg 编著,《生物学和医学中的 FLIM 显微技术》。CRC Press 2009
- Periasamy, N. Mazumder, Y. Sun, K. G. Christopher, R. N. Day, FRET Microscopy:FLIM-FRET成像的基础、问题和优势。W. Becker (ed.), FLIM-FRET Imaging:W. Becker (ed.) Advanced time-correlated single photon counting applications.Springer, Berlin, Heidelberg, New York (2015)
- Peter, S.M. Ameer-Beg, 多光子荧光成像的分子相互作用成像,《细胞生物学》96, 231-236 (2004)
- Peter, S.M. Ameer-Beg, M.K.Y. Hughes, M.D. Keppler, S. Prag, M. Marsh, B. Vojnovic, T. Ng, Multiphoton-FLIM quantifcation of the EGFP-mRFP1 FRET pair for localization of membrane receptor-kinase interactions, Biophys.J.88, 1224-1237 (2005)
- Richert, P. Didier, H. de Rocquigny, Y. Mély, 通过 FLIM FRET 显微镜监测 HIV-1 蛋白聚合。In:W. Becker (ed.) Advanced time-correlated single photon counting applications.Springer, Berlin, Heidelberg, New York (2015)
- Rickman, C.N. Medine, A. Bergmann, R.R. Duncan, MUNC18-syntaxin 1互作的功能和空间差异模式。JBC 282, 12097-12103 (2007)
- Rickman, C. N. Medine, A. R. Dun, D. J. Moulton, O. Mandula, N. D. Halemani, S. O. Rizzoli, L. H. Chamberlain, and R. R. Duncan, t-SNARE Protein Conformations Patterned by the Lipid Microenvironment.J. Biol.Chem.285, 13535-13541 (2010)
- Rickman, R. R. Duncan, Munc18/Syntaxin Interaction Kinetics Control Secretory Vesicle Dynamics.J. Biol.Chem.285, 3965-3972 (2010)
- L.Rusanov, A.P. Savitsky, Fluorescence resonance energy transfer between fluorescent proteins as powerful toolkits for in vivo studies.Laser Phys.8(2) 91-102 (2011)
- Snippe, J.W. Borst, R. Goldbach, R. Kormelik, The use of fluorescence microscopy to visualise homotypic interactions of tomato spotted wilt virus nucleocapsid protein in living cells, J. Vir.Meth.125, 12-15 (2005)
- Ueda、S. Kwok、Y. Hayashi, FRET 探针在神经元可塑性分析中的应用,神经回路前沿 7, 163 (2013)
- Valkonen、E. R. Kalkman、M. Saloheimo、M. Penttilä、N. D. Read、R. R. Duncan, 活真菌细胞中空间隔离的蜗牛蛋白相互作用。JBC 282, 22775-22785 (2007)
- S.S. Vogel, C. Thaler, S. V. Koushik, Fanciful FRET.STKE 2006, re2 (2006)
